3月3日,國家藥監局官網顯示,葛蘭素史克多替拉韋拉米夫定片已正式獲NMPA批準上市,用于治療用于治療感染人類免疫缺陷病毒1型 (HIV-1) 的成人和12歲以上青少年(體重至少40公斤),且對整合酶抑制劑或拉米夫定無已知或可疑耐藥患者。 多替拉韋拉米夫定片(Dov
3月3日,國家藥監局官網顯示,葛蘭素史克多替拉韋拉米夫定片已正式獲NMPA批準上市,用于治療用于治療感染人類免疫缺陷病毒1型 (HIV-1) 的成人和12歲以上青少年(體重至少40公斤),且對整合酶抑制劑或拉米夫定無已知或可疑耐藥患者。


多替拉韋拉米夫定片(Dovato)由GSK旗下的ViiV Healthcare研發,于2019/4/8獲得FDA批準上市,2019/7/3獲得歐盟批準, 2020年銷售額為4.83億美元。這是一種抗HIV感染的雙藥療法,有效性不劣于指南推薦的三藥療法,同時降低終生累積藥物暴露量和潛在長期毒性。也是FDA批準的首個用于既往從未接受過治療的成人HIV-1感染的雙藥固定劑量完整療法。

Dovato由固定劑量的多替拉韋和拉米夫定組成,其中,多替拉韋是一種HIV整合酶抑制劑,能夠通過阻止病毒DNA整合至人體免疫細胞的遺傳物質來阻斷HIV的復制。拉米夫定是一種核苷類逆轉錄酶抑制劑,常與其他抗逆轉錄病毒藥物聯合使用,用于HIV感染的治療。
一項代號為ANGO的開放標簽、多中心、III期研究評估了處于病毒學抑制階段( HIV-1 RNA <50 拷貝/mL)的HIV-1感染成人患者換藥為Dovato的療效、安全性和耐受性。研究結果顯示,第48周時,接受Dovato治療患者HIV-1 RNA ≥50 拷貝/mL 患者比例與繼續接受替諾福韋艾拉酚胺(TAF)為基礎3聯或4聯治療方案患者比例無顯著性差異( 0.3% (1/369) vs 0.5% (2/372)) ,達到非劣效性標準,治療過程中無病毒學失敗或緊急耐藥性報告。


去年2月25日,多替拉韋拉米夫定片上市申請按優先審評范圍(一)3款具有明顯治療優勢藥品被CDE納入優先審評。距離獲批,僅用了1年時間。

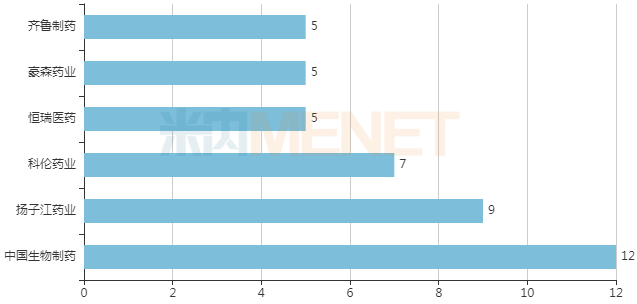
作為目前國內艾滋病領域市場份額占比最大企業,截止目前GSK已有12款HIV治療藥物在中國上市,多替拉韋拉米夫定片的上市將進一步鞏固GSK在這一領域位置。

艾滋病領域企業市場份額占比(來源:醫藥魔方IPM數據庫)
本文來源:醫藥魔方Plus 作者:小編 免責聲明:該文章版權歸原作者所有,僅代表作者觀點,轉載目的在于傳遞更多信息,并不代表“醫藥行”認同其觀點和對其真實性負責。如涉及作品內容、版權和其他問題,請在30日內與我們聯系
 客服微v信:
客服微v信:








 京公網安備 11010802031568號
京公網安備 11010802031568號

