5款新藥被納入擬優先審評品種!來自榮昌生物、賽生醫藥、禮來、諾華 來源:藥智網 8月26日,根據國家藥品監督管理局藥品審評中心(CDE)公示,5品種上市申請被擬納入優先審評審批,包括禮來的Selpercatinib膠囊、北京諾華的曲美替尼片和甲磺酸達拉非尼膠囊、
5款新藥被納入擬優先審評品種!來自榮昌生物、賽生醫藥、禮來、諾華
來源:藥智網

8月26日,根據國家藥品監督管理局藥品審評中心(CDE)公示,5品種上市申請被擬納入優先審評審批,包括禮來的Selpercatinib膠囊、北京諾華的曲美替尼片和甲磺酸達拉非尼膠囊、賽生醫藥的那昔妥單抗注射液,以及榮昌生物的注射用緯迪西妥單抗。

來源:CDE官網
禮來RET抑制劑:Selpercatinib
禮來制藥的Selpercatinib膠囊2個適應癥上市申請擬納入優先審評,擬定適應癥(或功能主治):(1)用于RET突變的需要系統性治療的晚期或轉移性甲狀腺髓樣癌(MTC)成人和12歲及以上兒童患者的治療。本品用于RET基因融合陽性的需要系統性治療和放射性碘治療(如適用)難治的晚期或轉移性甲狀腺癌成人和12歲及以上兒童患者的治療。(2)用于轉染重排(RET)基因融合陽性的局部晚期或轉移性非小細胞肺癌(NSCLC)患者的治療。
Selpercatinib是禮來研發的一種強效、口服、高度選擇性轉染期間重排 (Rearranged During Transfection, RET) 激酶抑制劑,同時也是首個靶向 RET 激酶的抑制劑,通過抑制異常 RET 激酶的活性而發揮作用。
該藥已先后獲得美國 FDA 三項突破性療法認證和優先審評審批資格,并于 2020 年 5 月 8 日經美國 FDA 批準上市(商品名 Retevmo),適用于甲狀腺腫瘤、甲狀腺髓樣瘤和轉移性非小細胞瘤。同時,在歐盟和美國也有多個適應癥已提交上市申請,在國內的研發最高已到III期臨床階段。
諾華雙靶向組合療法:曲美替尼+達拉非尼
諾華(Novartis)經典雙靶向組合療法——達拉非尼/曲美替尼擬納入優先評審,適用于治療BRAF V600突變陽性的晚期非小細胞肺癌患者。
達拉非尼和曲美替尼均為GSK研發的BRAF/MEK抑制劑,現歸諾華所有。這兩種藥物聯合使用,可以同時抑制BRAF和MEK兩個靶點,達到比單藥更好的效果。多項全球關鍵性臨床研究結果顯示,對比靶向單藥治療,達拉非尼和曲美替尼聯合使用可幫助晚期BRAF V600突變黑色素瘤患者,得到更高的疾病緩解,實現更長的無進展生存。
2019年12月,該組合在國內上市,NMPA批準達拉非尼與曲美替尼用于治療BRAF V600突變陽性的不可切除或轉移性黑色素瘤;2020年3月,達拉非尼與曲美替尼再次獲批聯合用于BRAF V600突變陽性的III期黑色素瘤患者完全切除后的輔助治療。
早在2017年6月,達拉非尼/曲美替尼組合療法就已獲得美國FDA批準,用于治療腫瘤攜帶BRAF V600E突變的非小細胞肺癌患者。根據諾華早前發布的新聞稿,這是肺癌領域一個重要的里程碑。達拉非尼/曲美替尼組合療法的獲批,使BRAF V600E成為繼EGFR、ALK和ROS-1之后第四個在轉移性非小細胞肺癌中可行的基因組生物標記物。
賽生藥業GD2抗體新藥:那昔妥單抗注射液
賽生藥業(SciClone Pharmaceuticals)申報的那昔妥單抗注射液上市申請已被納入擬優先審評,擬開發用于治療復發性或難治性高危神經母細胞瘤患者。
那昔妥單抗是是全球首款獲批的人源化神經節苷脂GD2單克隆抗體,已于2020年11月在美國獲批治療神經母細胞瘤患者。該藥曾獲FDA授予的優先審評資格、突破性療法認定和孤兒藥資格。
在國內,賽生藥業與其原研藥企Y-mAbs Therapeutics達成獨家授權許可協議,獲得了那昔妥單抗在大中華地區的獨家合作開發和商業化權利,并在博鰲樂城率先落地這款創新的免疫治療藥物,惠及國內神經母細胞瘤患兒。
今年7月,在美國獲批上市僅七個多月后,賽生藥業就已向中國國家藥品監督管理局(NMPA)正式遞交那昔妥單抗(naxitamab-gqgk,Danyelza)的上市許可申請并獲受理。
榮昌生物ADC:注射用維迪西妥單抗
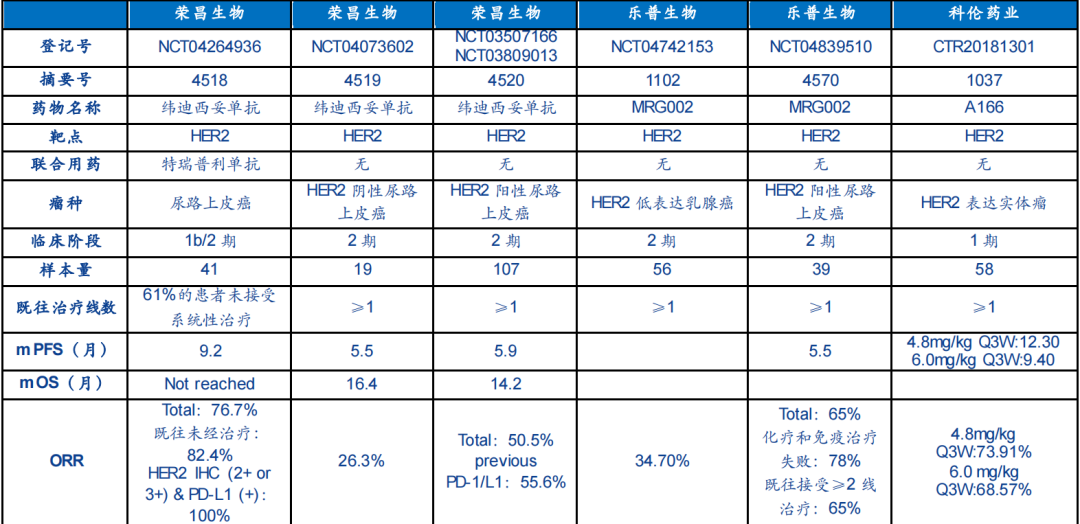
榮昌生物研發的注射用維迪西妥單抗的新適應癥上市申請擬納入優先審評,用于既往接受過系統化療且HER2表達為免疫組化檢查結果為2+或3+的局部晚期或轉移性尿路上皮癌(UC)患者。 這意味著,這款HER2靶向ADC藥物繼胃癌適應癥獲批后,有望加速迎來第2個癌癥適應癥的獲批。
維迪西妥單抗(disitamab vedotin,RC48)是首款由中國公司自主研發并獲批上市的ADC。今年6 月,注射用維迪西妥單抗通過優先審評程序獲國家藥監局附條件批準上市,適用于至少接受過 2 種系統化療的 HER2 過表達局部晚期或轉移性胃癌(包括胃食管結合部腺癌)患者的治療。這是國內第三個獲批的ADC抗體,也是首個國產ADC藥物。
維迪西妥單抗在中國曾兩次被納入突破性治療品種,適應癥有:1)HER2過表達局部晚期或轉移性尿路上皮癌,且既往經過化療失敗后進展的患者;2)HER2陽性存在肝轉移的晚期乳腺癌,且既往接受過曲妥珠單抗和紫杉類藥物治療的患者。
此外,維迪西妥單抗還在2020年9月被美國FDA授予突破性療法認定,用于尿路上皮癌二線治療。2020年11月,FDA授予維迪西妥單抗治療胃癌適應癥的快速通道資格。
責任編輯:琉璃
聲明:本文系藥智網整合內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容。
本文來源:藥智 作者:小編 免責聲明:該文章版權歸原作者所有,僅代表作者觀點,轉載目的在于傳遞更多信息,并不代表“醫藥行”認同其觀點和對其真實性負責。如涉及作品內容、版權和其他問題,請在30日內與我們聯系
 客服微v信:
客服微v信:








 京公網安備 11010802031568號
京公網安備 11010802031568號

